Природный минерал корунд, использующийся как абразивный материал, является:
В разбавленном водном растворе с карбонатом калия при 20 °C реагируют вещества:
а) 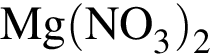
б) ![]()
в) 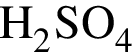
г) ![]()
Электронная конфигурация атома некоторого элемента в основном состоянии 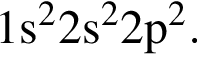 Этому элементу в периодической системе соответствуют группа и номер периода:
Этому элементу в периодической системе соответствуют группа и номер периода:
Кислота является конечным продуктом в цепи превращений:
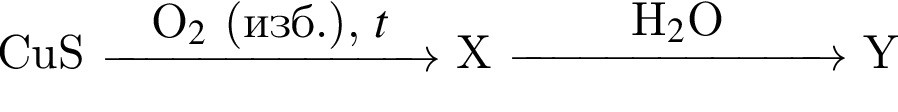
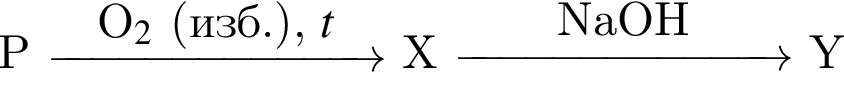
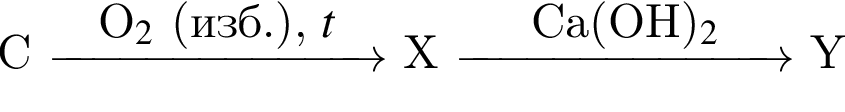
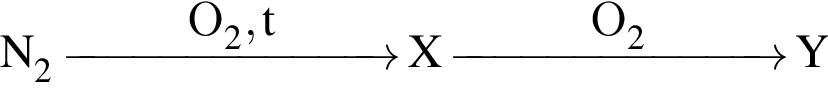
Выберите химическое явление:
Укажите процесс, одним из продуктов которого является кислород:
Водный раствор фенолфталеина окрасится, если к нему добавить:
Ковалентной полярной и ионной связями образовано вещество:
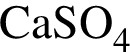
Высшую степень окисления в соединениях, равную +2, проявляет элемент:
Выберите правильные утверждения:
а — наименьшей электропроводностью среди металлов обладает серебро
б — палладий относят к цветным металлам
в — ионы ![]() являются более сильным окислителем в водном растворе, чем ионы
являются более сильным окислителем в водном растворе, чем ионы ![]()
г — медь НЕ растворяется в разбавленной азотной кислоте
В закрытой системе протекает одностадийное превращение
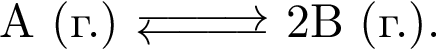
После установления равновесия давление в системе увеличили в три раза.
Укажите правильное утверждение:
Укажите общие(-ее) свойства(-о) для кальция и магния:
а) реагируют с соляной кислотой, образуя водород
б) возможна реакция со щелочами: 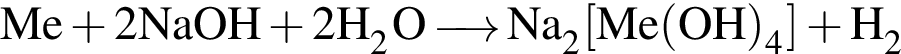
в) карбонаты разлагаются при нагревании
г) электронная конфигурация внешнего энергетического уровня — ns1
Согласно положению в периодической системе в порядке усиления неметаллических свойств элементы расположены в ряду:
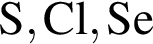
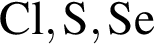
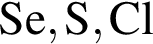
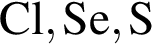
О протекании химических процессов в водном растворе свидетельствует:
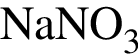 в воде при повышении температуры
в воде при повышении температурыВ отличие от пентана вещество, формула которого представлена на рисунке:
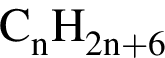 .
.Число пептидных связей в молекуле равно:
Соль А, известная под названием растворимое стекло, образована металлом группы IA. При пропускании избытка углекислого газа через водный раствор A образуется соль Б и плохо растворимая в воде кислота В. При нагревании В разлагается на воду и оксид Г. Сплавление Г с содой приводит к образованию исходной соли А и не имеющего запаха газообразного вещества Д. Найдите сумму молярных масс(г/моль) веществ Б, Г, Д.
Укажите реагент, с помощью которого можно качественно отличить раствор уксусного альдегида от раствора уксусной кислоты:
1) соляная кислота
2) раствор гидрокарбоната натрия
3) раствор хлорида бария
4) раствор фенолфталеина
Для получения веществ по указанной схеме превращений
![]() →
→ ![]() →
→ ![]() →
→ ![]() →
→ ![]()
выберите реагенты из предложенных:
1 — ![]()
2 — ![]()
3 — 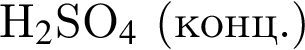
4 — ![]()
5 — ![]()
Ответ запишите цифрами в порядке следования превращений, например: 1224. Помните, что один реагент может использоваться несколько раз, а другой — не использоваться вообще.
В четырех пронумерованных пробирках находятся растворы неорганических веществ. О них известно следующее:
-вещества из пробирок 1 и 4 нейтрализуют друг друга
-при добавлении к содержимому пробирки 2 вещества из пробирки 4 выпадает осадок бурого цвета
-вещества из пробирок 3 и 4 реагируют между собой с образованием осадка, способного растворяться как в кислотах, так и в щелочах.
Установите соответствие между названием неорганического вещества и номером пробирки, в которой находится раствор данного вещества.
А) хлорид алюминия
Б) гидроксид натрия
В) серная кислота
Г) нитрат железа (III)
1
2
3
4
Найдите сумму коэффициентов перед формулами брома и воды в уравнении реакции, схема которой
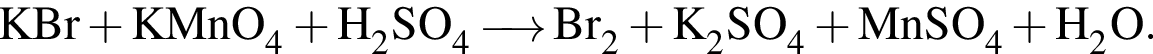
Укажите реагент, с помощью которого можно качественно отличить раствор уксусного альдегида от пропанола:
1) аммиачный раствор оксида серебра (I)
2) раствор гидроксида натрия
3) раствор хлорида железа (III)
4) раствор гидрокарбоната натрия
Найдите сумму коэффициентов перед формулами сульфида калия и воды в уравнении реакции, схема которой
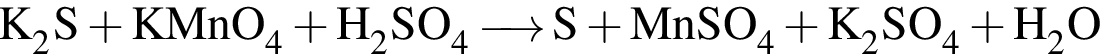
Установите соответствие между названием органического соединения и общей формулой гомологического ряда, к которому принадлежит это соединение.
A) 2-метилпропанол-2
Б) 2,2-диметилпропан
B) гексен-1
Г) 3-метилпентин-1
1) ![]()
2) 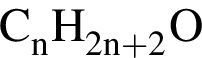
3) 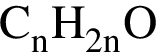
4) 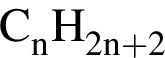
5) 
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А3Б2В5Г1. Помните, что некоторые данные правого столбца могут использоваться несколько раз или вообще не использоваться.
Установите соответствие между превращением и формулой реагента, необходимого для его осуществления.
А) 
Б) 
В) 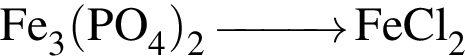
Г) 
1) ![]()
2) ![]()
3) ![]()
4) ![]()
5) ![]()
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А2Б1В4ГЗ.
Дан перечень соединений: 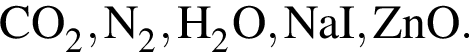 Определите число соединений, которые могут реагировать с оксидом калия.
Определите число соединений, которые могут реагировать с оксидом калия.
В результате полного восстановления оксида меди(II) углеродом была получена смесь угарного и углекислого газов количеством 1,7 моль и массой 63,6 г. Рассчитайте массу (г) образовавшейся при этом меди.
Для получения веществ по схеме превращений

выберите реагенты из предложенных (на стадии 4 прибавляйте газообразное при н. у. вещество):
1) ![]()
2) 
3) ![]()
4) 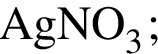
5) ![]()
6) ![]()
7) ![]()
Ответ запишите цифрами в порядке следования превращений, например: 2443. Помните, что один и тот же реагент может использоваться несколько раз или не использоваться вообще.
Дана схема превращений
Рассчитайте сумму молярных масс (г/моль) галогенсодержащих солей X и Y.
Установите соответствие между схемой обратимой реакции и направлением смещения равновесия при увеличении давления.
А) 
Б) 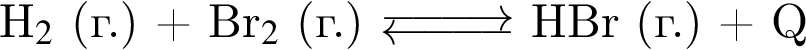
В) 
Г) 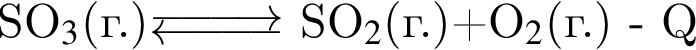
1 — вправо (в сторону продуктов)
2 — влево (в сторону исходных веществ)
3 — НЕ смещается
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б2ВЗГЗ.
Установите соответствие между исходными веществами и суммой коэффициентов в полном ионном уравнении реакции. Все электролиты взяты в виде разбавленных водных растворов.
А) ![]() и
и ![]()
Б) ![]() и
и 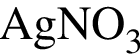
В) ![]() и
и 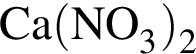
Г) ![]() и
и 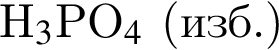
1 — 6
2 — 8
3 — 12
4 — 14
5 — 17
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б4ВЗГ2.
Для обратимой реакции 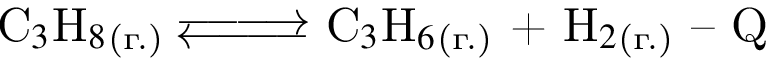 установите соответствие между воздействием на равновесную систему и направлением смещения равновесия.
установите соответствие между воздействием на равновесную систему и направлением смещения равновесия.
А) использование катализатора
Б) понижение температуры
В) повышение давления
Г) уменьшение концентрации продуктов
1 — вправо (в сторону продуктов)
2 — влево (в сторону исходного вещества)
3 — не смещается
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца, например: А1Б2ВЗГ1
Относительная плотность смеси озона и кислорода по гелию равна 8,8. Определите минимальный объем (дм3, н. у.) такой смеси, необходимой для полного окисления смеси ацетилена, бутана и 2-метилпропана масcой 100 г и относительной плотностью по водороду 26,6.
К 30 дм3 смеси, состоящей из пропана и аммиака, добавили 10 дм3 хлороводорода. После приведения новой газовой смеси к первоначальным условиям ее относительная плотность по воздуху составила 0,80. Укажите массовую долю (%) пропана в исходной смеси. (Все объемы измеряли при t = 20 °C, Р = 105 Па.)
Установите соответствие между парой веществ и реагентом, позволяющим различить вещества пары. Все реакции
протекают в разбавленном водном растворе.
А) 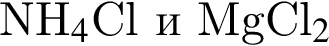
Б) 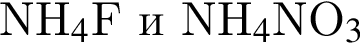
В) 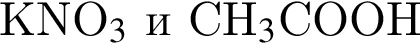
Г) 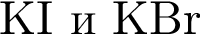
1) ![]()
2) ![]()
3) 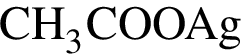
4) 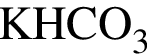
Ответ запишите в виде сочетания букв и цифр, соблюдая алфавитную последовательность букв левого столбца,
например: А1Б4ВЗГ2.
Сгорание угля протекает в соответствии с термохимическим уравнением:
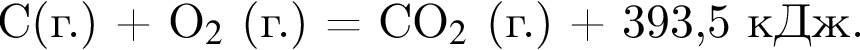
Найдите массу (г) сгоревшего угля, в котором массовая доля негорючих примесей 20 %, если в результате реакции выделилось 1574 кДж теплоты.
Выберите утверждения, верно характеризующие фосфорную кислоту:
| 1 | массовая доля кислорода составляет 65,3% |
| 2 | химическая формула 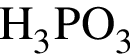 |
| 3 | в реакциях с металлами образует только средние соли |
| 4 | используется в производстве кормовых добавок |
| 5 | при электролитической диссоциации образует три различных аниона |
| 6 | взаимодействует с кремнеземом |
Ответ запишите цифрами (порядок записи цифр не имеет значения), например: 236
Расположите водные растворы веществ в порядке уменьшения их pH:
1) 0,5 моль/дм3 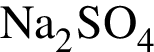
2) 0,5 моль/дм3 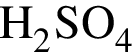
3) 0,5 моль/дм3 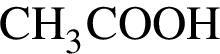
4) 0,5 моль/дм3 ![]()



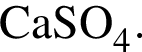
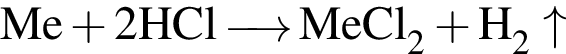 .
.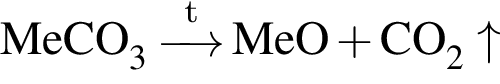 .
.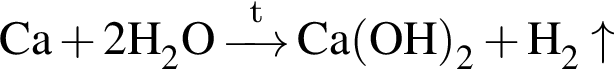 .
.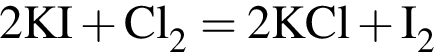
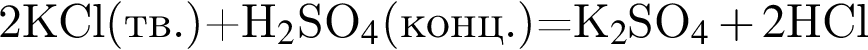
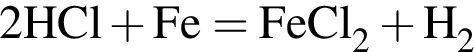
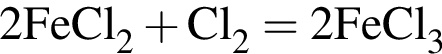
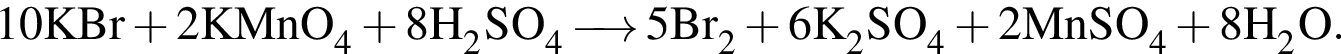
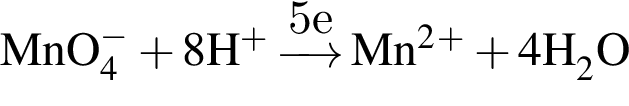
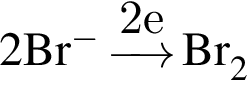

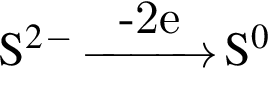 восстановитель
восстановитель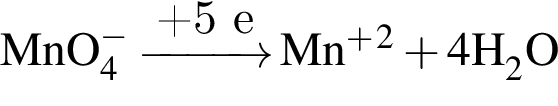 окислитель
окислитель

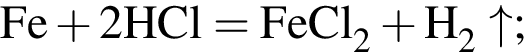

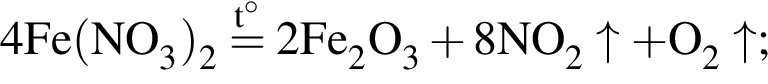
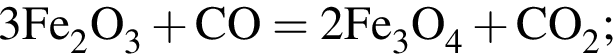
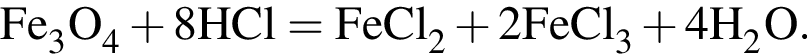
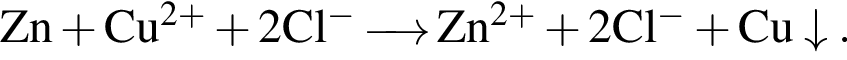 Сумма коэффициентов — 8.
Сумма коэффициентов — 8.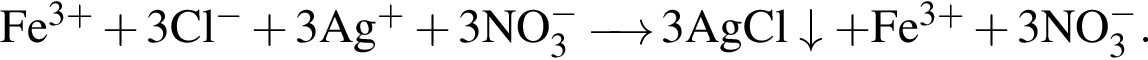 Сумма коэффициентов — 17.
Сумма коэффициентов — 17.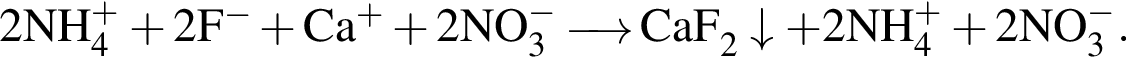 Сумма коэффициентов — 12.
Сумма коэффициентов — 12. Сумма коэффициентов — 6.
Сумма коэффициентов — 6.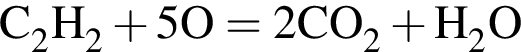
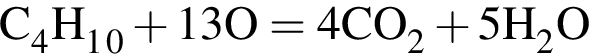
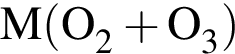 =8.8 · 4=35.2 г/моль
=8.8 · 4=35.2 г/моль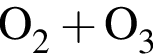 содержит 0,8 моль
содержит 0,8 моль 
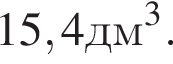 Следовательно, в исходной смеси объем аммиака = 15,4+10 = 25,4
Следовательно, в исходной смеси объем аммиака = 15,4+10 = 25,4 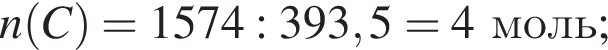
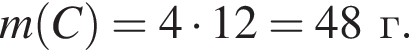
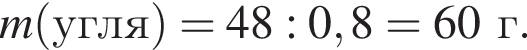
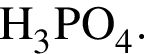 Массовая доля кислорода составляет:
Массовая доля кислорода составляет: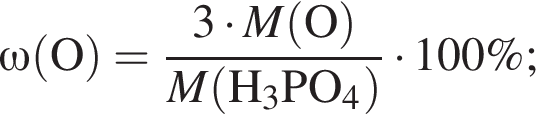
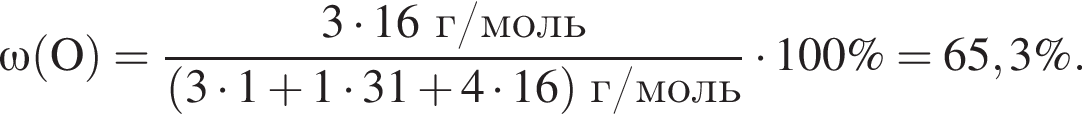
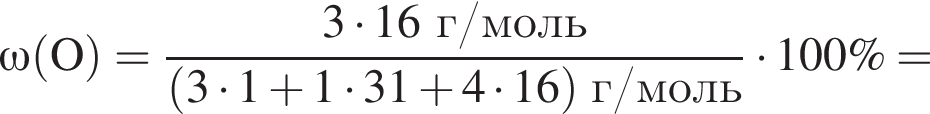
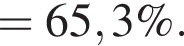

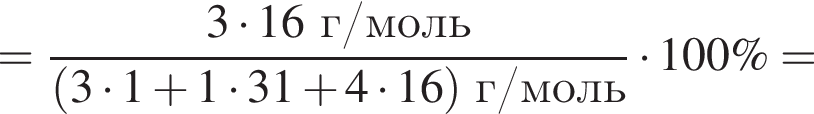

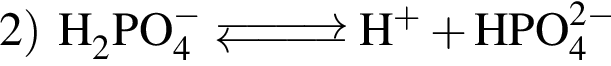
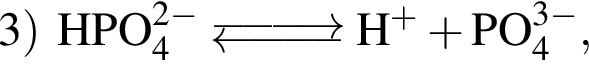
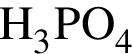 — кислота, поэтому взаимодействует с основными оксидами (
— кислота, поэтому взаимодействует с основными оксидами (